一部のカイアシ類はDHA合成能を有する その他のDHA獲得の方法
カイアシ類は主に海水または汽水、淡水で浮遊生活をする微小甲殻類であり、数と量ともに優占することがしばしばある。そのため、食物連鎖による生態系への貢献度の大きさは類を見ない。
近年の健康意識の向上によりDHAの認知度は高い。高濃度DHAをうたう栄養食品やサプリメントが市場に出回っている。DHAは脂肪酸合成における終着点であり、生体内への影響は大きい。DHAが欠乏すると生存率にも影響する程だ(たとえば、Ishikawa et al. 2019)。Fig. 1に脂肪酸の合成経路を示した図を表す。
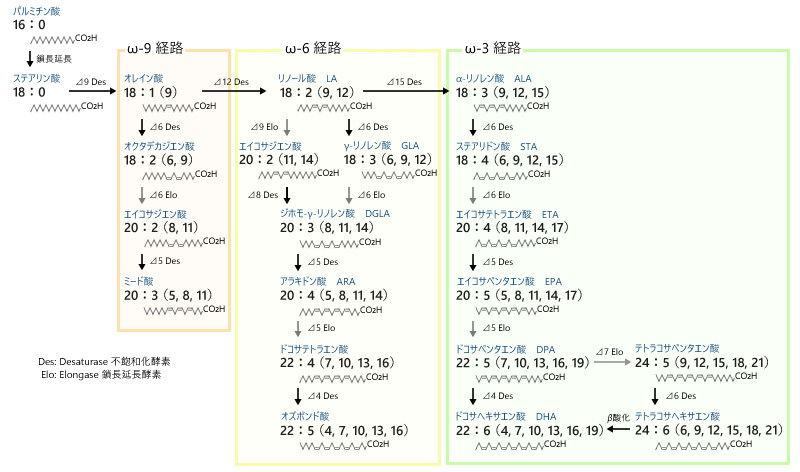
多くの動物はω-9経路内、ω-6経路内、ω-3経路内であれば順に合成が可能だが、各経路を経由することはできない(齋藤 1999)。つまり、Fig. 1の⊿12、⊿15不飽和化酵素を備えていない。また、ω-3経路内であっても、⊿4または⊿5不飽和化酵素は活性が低いか欠損するためDHAへの合成能は低い(竹内 1991)。ヒトにおいては、ALA(α-リノレン酸)からDHAへの変換率は0~9%である(Burdge et al. 2002a;Burdge et al. 2002b)。したがって、DHAの合成が可能な生物を摂餌して得る必要がある。
動物はDHAを合成することが難しい。とくにオレイン酸からDHAを合成するのは、酵素を備えていないため不可能。そう考えられていた。しかし、海産動物、いくつかの動物群にはその酵素を有することが遺伝子解析により判明した。Kabeyaら(2018)は⊿12、⊿15不飽和化酵素(以降、ωx不飽和化酵素)をコードする遺伝子を同定し、既にデーターベースで登録されている遺伝子から探した。結果、以下にあげる動物はωx不飽和化酵素遺伝子を有することを見出した。
- 線形動物 Ascaridida, Rhabditida, Diplogasterida, Spirurida
- 刺胞動物 Actiniaria, Scleractinia, Corallimorpharia, Zoantharia
- 輪形動物 Adineta, Rotaria
- 環形動物 Hirydinea, Oligochaeta, Palpata, Scolecida
- 二枚貝 Elliptio complanata (イシガイの一種)
- 腹足類 Caenogastropoda, Heterobranchia, Patellogastropoda, Vetigastropoda
- 頭足類 Decapodiformes(イカ類), Octopodiformes(タコ類)
- 昆虫など Sminthurus viridis(トビムシの一種), Bemisia tabaci(タバココナジラミ), Locusta migratoria(トノサマバッタ)
カイアシ類は以下の通り。
- Caligus rogercresseyi (Siphonostomatoida, Caligidae)
- Eucyclops serrulatus (Cyclopoida, Cyclopidae)
- Lepeophtheirus salmonis (Siphonostomatoida, Caligidae)
- Paracyclopina nana (Cyclopoida, Cyclopettidae)
- Tigriopus carifornicus (Harpacticoida, Harpacticidae)
- Tigriopus japonicus (Harpacticoida, Harpacticidae)
- Tigriopus sp. (Harpacticoida, Harpacticidae)
ωx不飽和化酵素遺伝子を有するカイアシ類Tigriopus californicusにおいて、実際に合成経路の初期の脂肪酸、オレイン酸からDHAを合成することも確かめられた(Kabeya 2021)。これは、従来までの定説「動物はDHAをオレイン酸から合成できない」を覆す、驚くべきものだ。
魚類の場合、海水に生息するほとんどの種はALAからDHAを合成できない。しかし、汽水種はある程度、DHAを合成でき、陸水種にいたってはDHAを十分に合成ができる。これは、DHA合成遺伝子Fads2が、陸水へ生息域を移す度に重複し、酵素活性が高まったからだという(Ishikawa et al. 2019)。DHAが欠乏する汽水に生息するカイアシ類、Apocyclops royi (Lindlerg, 1940)とPseudodiaptomus annandalei (Sewell, 1919)は、同位体元素による元素標識でALAからDHAを合成することを裏付けた(Nielson et al. 2020)。DHAを欠く餌でも十分にDHAを合成することを確かめている(Nielson et al. 2019)。魚類の場合を考慮すると、DHAの高い合成能は、DHAが欠乏する汽水ないし陸水へ進出する上で重要なものかもしれない。
ωx不飽和化酵素遺伝子を見いだされたカイアシ類は一部の分類である。他のカイアシ類、例えばカラヌス目(Calanoida)にはない。海洋において豊富な生物量をもち、食物連鎖の要とも言えるCalanusも、その一例である。Calanusは構成される全脂肪酸のうち9.3±3.9%がDHAだが(Parrish et al. 2012)、Calanusはωx不飽和化酵素を持たない(Kabeya et al. 2018)。そのうえ、ALAからDHAへの変換率は96時間で0.035%と、ほぼDHAを合成することができない(Bell et al. 2007)。ゆえに、DHAを摂餌によって得る必要がある。
しかしながら、消化管内容物の形態観察ではDHAを合成できるのであろう藻類は、消化により分解され同定はできなかった(Chen et al. 2010)。そこでHiraiら(2018)は消化管内容物に含まれる餌生物のDNAからメタバーコーディングを用いた遺伝子解析で藻類の種を定量的に同定した。結果、これまで見出されなかったラビリンチュラ類を多く検出したのだ。そのDNA量は、オピストコンタ(刺胞動物、鞘甲類、カイアシ類など)を除いた全藻類の40%、オピストコンタを含めば12.5%であった。これは環境中のラビリンチュラ類よりも多く、Calanusは積極的に摂餌していることになる。
ラビリンチュラ類はDHA合成能を有し、蓄積ができる藻類である(Ellenbogen et al. 1969)。そのため、全脂肪酸の58~68%がDHAと、極めて多い(Sakata et al. 2000)。しかし、ラビリンチュラ類の大きさは10 μmもなく、Calanusの摂食に関わる付属肢の篩目50 μm程ではラビリンチュラ類を掬い取ることができない。では、どうやってラビリンチュラ類を摂餌するのか。それは、ラビリンチュラ類の生態に関わる。ラビリンチュラ類は餌粒子に集まって、凝集粒子あるいはコロニーを形成して水柱を浮遊するという(Marchan et al. 2017)。これによって、篩目以上の大きさとなり、Calanusはラビリンチュラ類の摂餌を可能にしているのだ。
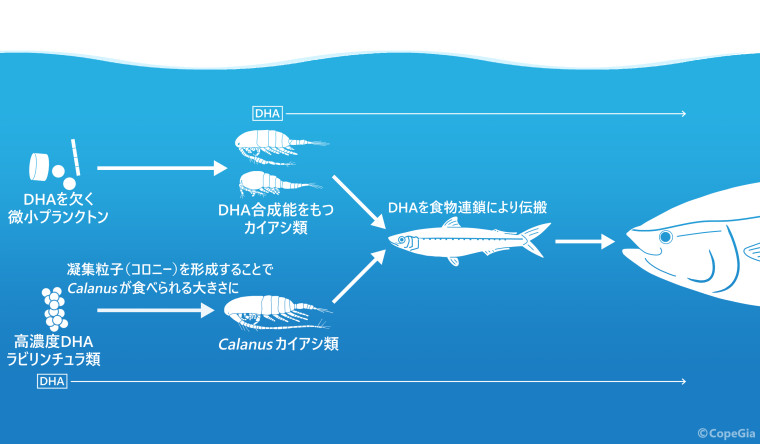
カイアシ類は動物プランクトンの中では数と量ともに優占するほど豊富にある。それは、全体の90%を占めるほどだ(Wiebe et al. 2013)。全長20 cm以下の魚類であれば、それらの消化管内容物の大半ないし全てがカイアシ類である(例えば、浜田・木下 1988;日比野ら 1999;桑原・鈴木 1984)。魚類はDHAを合成できないのがほとんどでありながら、DHAの要求度は高い(竹内 1991)。つまり、DHAの供給は、カイアシ類に依存していることになる。カイアシ類は食物連鎖の上で重要だと説明されることが多いが、これはDHAでも言えよう。
文 献
Bell MV, Dick JR, Anderson TR, Pond DW (2007) Application of liposome and stable isotope tracer techniques to study polyunsaturated fatty acid biosynthesis in marine zooplankton. J. Plankton Res. 29 (5): 417-422.
Burdge GC, Jones AE, Wootton SA (2002a) Eicosapentaenoic and docosapentaenoic acids are the principal products of alpha-linolenic acid metabolism in young men. Br. J. Nutr. 88 (4): 355-364.
Burdge GC, Wootton SA (2002b) Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br. J. Nutr. 88 (4): 411-420.
Chen M-R, Ka S, Hwang J-S (2010) Diet of the copepod Calanus sinicus Brodsky, 1962 (Copepoda, Calanoida, Calanidae) in northern coastal water of Taiwan during the northeast monsoon period. Crustaceana 84 (7): 841-864.
Ellenbogen BB, Aaronson G, Goldstein S, Belsky M (1969) Polyunsaturated fatty acids of aquatic fungi: Possible phylogenetic significance. Comp. Biochem. Phys. 29 (2): 805-811.
浜田理香・木下 泉 (1988) 土佐湾の砕波帯に出現するアユ仔稚魚の食性. 魚類学雑誌 35 (3): 382-388.
日比野 学・上田拓史・田中 克 (1999) 筑後川河口域におけるカイアシ類群集とスズキ仔稚魚の摂餌. 日本水産学会誌 65 (6): 1062-1068.
Hirai J, Hamamoto Y, Honda D, Hidaka K (2018) Possible aplanochytrid (Labyrinthulea) pray detected using 18S metagenetic diet analysis in the key copepod species Calanus sinicus in the coastal waters of subtropical western North Pacific. Plankton. Benthos Res. 13 (2): 75-82.
Ishikawa A, Kabeya N, Ikeya K, Kakioka R, Cech JN, Osada N, Leal MC, Inoue J, Kume M, Toyoda A, Tezuka A, Nagano AJ, Yamasaki YY, Suzuki Y, Kokita T, Takahashi H, Lucek K, Marques D, Takehana Y, Naruse K, Mori S, Monroig O, Ladd N, Schubert CJ, Matthews B, Peichel CL, Seehausen O, Yoshizaki G, Kitano J (2019) A key metabolic gene for recurrent freshwater colonization and radiation in fishes. Science 364 (6443): 886-889.
Kabeya N, Fonseca MM, Ferrier DEK, Navarro JC, Bay JK, Francis DS, Tocher DR, Castro JFC, Monroig O (2018) Genes for de novo biosynthesis of omega-3 polyunsaturated fatty acids are widespread in animals. Sci. Adv. 4: eaar6849.
Kabeya N, Ogino M, Ushio H, Haga Y, Satoh S, Navarro JC, Monroig Ó (2021) A complete enzymatic capacity for biosynthesis of docosahexaenoic acid (DHA, 22: 6n–3) exists in the marine Harpacticoida copepod Tigriopus californicus. Open Biol. 11: 200402.
桑原昭彦・鈴木重喜 (1984) 若狭湾西部海域におけるカタクチイワシ卵・稚仔魚の鉛直分布の昼夜変化. 日本水産学会誌 50 (8): 1285-1292.
Marchan LF, Chang KJL, Nichols PD, Mitchell WJ, Polglase JL, Gutierrez T (2017) Taxonomy, ecology and biotechnological application of thraustochytrids: A review. Biotechnol. Adv. 36 (1): 26-46.
齋藤洋昭 (1999) 高度不飽和脂肪酸について―分類と機能―. 中央水研研報 14: 59-78.
Sakata T, Fujisawa T, Yoshikawa T (2000) Colony formation and fatty acid composition of marine labyrinthulid isolates grown on agar media. Fish. Sci. 66: 84-90.
竹内俊郎 (1991) 魚類における必須脂肪酸要求の多様性. 化学と生物 29 (9): 571-580.
Wiebe PH, Lawson GL, Lavery AC, Copley NJ, Horgan E, Bradley A (2013) Improved agreement of net and acoustical methods for surveying euphausiids by mitigating avoidance using a net-based LED strobe light system. ICES J. Mar. Sci. 70 (3): 650-664.
