餌としてのカイアシ類 魚類の餌生物サイズの選択性
カイアシ類は主に海洋で浮遊生活をする、1 mm~3 mm程度の微小な甲殻類です。節足動物門、甲殻亜門、
注目すべきことは、その数と量です。個体数は、動物プランクトン全ての個体数のうち70~90%を占め(Carlotti etal. 2018)、世界中の海域で
どのくらいの大きさまでに成長したら、摂餌する餌生物の大きさが、カイアシ類よりも大きくなるのでしょうか。スズキの場合は、全長130~200 mmを超えると小型のエビなどを摂餌するようになります(畑中・関野 1962;日比野ら 1999)。サンマは200 mmを超えると、カイアシ類と合わせて、オキアミ類や
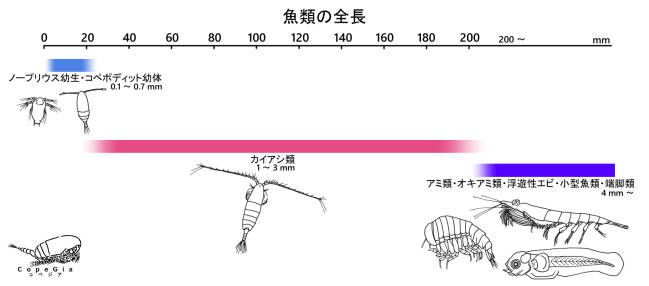
魚類の消化管内容物の餌生物の
サンマの仔稚魚は、黒潮海流の以南に分布します。この海域には小型1 mm未満のカイアシ類が多く、仔稚魚の餌生物として最適です。仔稚魚の間はここで過ごし、成長すると、黒潮海流の以北に移動します。親潮海流との混合域であるため、動物プランクトンは大型1~3 mmが多いです。サンマは成長することで、黒潮海流の以南から以北へ移動し、適した餌生物のサイズを選択しています。
カタクチイワシの場合は、仔稚魚のときに
魚類は、餌生物種を選択することはほとんどないですが、餌生物サイズを、海域を変えることで選択しているということが言えます。それによって、摂餌ができる最大の餌生物を摂餌することが可能になり、最適な成長を貢献できるということです。
文 献
Carlotti F, Pagano M, Guilloux L, Donoso K, Valdés V, Grosso O, Hunt B P V (2018) Mwso-zooplankton structure and functioning in the western tropical South Pacific along the 20th parallel south during the OUTPACE survey (February-April 2015). Biogeosciences 15: 7273-7297.
浜田理香・木下 泉 (1988) 土佐湾の砕波帯に出現するアユ仔稚魚の食性. 魚類学雑誌 35 (3): 382-388.
畑中正吉・関野清成 (1962) スズキの生態学的研究-I. スズキの食生活. 日本水産学会誌 28 (9): 851-856.
Hardy A (1965) The Open Sea: Its Natural History, Part 1: The World of Plankton. Collins, London. 657 pp.
日比野 学・上田拓史・田中 克 (1999) 筑後川河口域におけるカイアシ類群集とスズキ仔稚魚の摂餌. 日本水産学会誌 65 (6): 1062-1068.
堀田秀之・小達和子 (1956) サンマの食餌構成とその摂餌行動に就いて. 東北海区水産研究所業績 79: 60-69.
Ikeda T, Shiga N, Yamaguchi A (2008) Structure, biomass distribution and trophodynamics of the pelagic ecosystem in the Oyashio region, western Subarctic Pacific. J Oceanograph. 64: 339-354.
桑原昭彦・鈴木重喜 (1984) 若狭湾西部海域におけるカタクチイワシ卵・稚仔魚の鉛直分布の昼夜変化. 日本水産学会誌 50 (8): 1285-1292.
河野光久 (2007) 山口県日本沿岸域で漁獲されたマアジの食性. 山口県水産研究センター研究報告 5: 19-23.
Mauchline J (1998) The biology of calanoid copepods. Adv. Mar. Biol. 33: 1-710.
三谷 勇 (1988) 相模湾シラス漁場におけるカタクチイワシの食性. 日本水産学会誌 54 (11): 1859-1865.
小達和子 (1977) サンマの食性について. 東北水研研究報告 38: 75-88.
島崎健二・久新 健一郎 (1982) オホーツク海に出現するホッケ幼魚群. 北海道大学水産学部研究彙報 33: 229-239.
魚谷逸朗・斎藤 勉・平沼勝男・西川康夫 (1990) 北西太平洋産クロマグロThunnus thynnus仔魚の食性. 日本水産学会誌 56: 713-717.
Wiebe P H, Lawson G L, Lavery A C, Copley N J, Horgan E, Bradley A (2013) Improved agreement of net and acoustical methods for surveying euphausiids by mitigating avoidance using a net-based LED strobe light system. ICES J. Mar. Sci. 70 (3): 650-664.
山本昌幸・片山知史 (2012) 1995年の瀬戸内海燧灘東部におけるカタクチイワシとマイワシの食性の比較. 水産海洋研究 76: 66-76.
